Isoméres Z et E
Conditions de l'isomérie Z/E
Distinguer les isomères Z et E
La photo-isomérisation
1) Rappel
Deux molécules sont isomères si elles ont la même formule brute mais des formules développées différentes.
Exemple d'isomère du butène (C4H8):
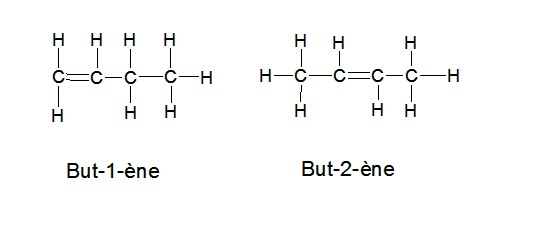
2) Conditions de l'isomérie Z/E
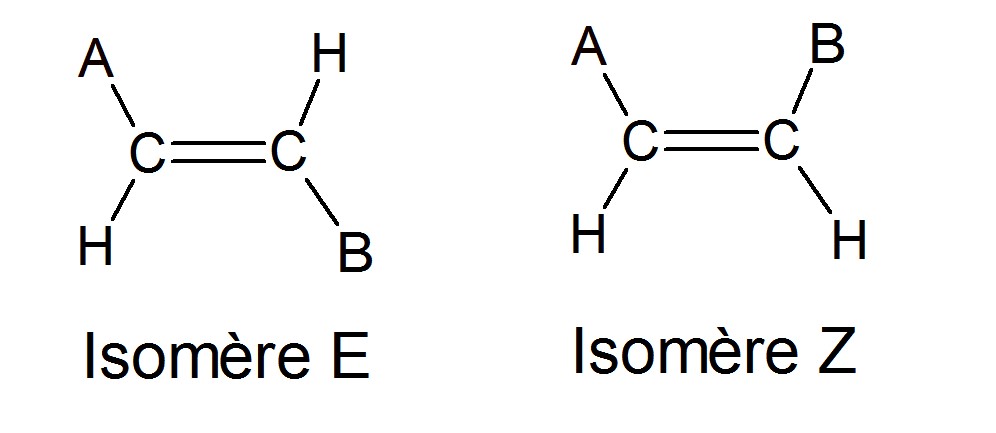
Une molécule peut exister sous deux formes dites isomère Z et isomère E si:
- elle possède une double liaison entre deux atomes de carbone
- si chaque carbone est lié à un hydrogène et à un autre groupement
3) Distinguer les isomères Z et E
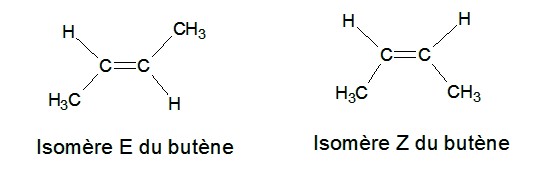
Z est la première lettre du mot allemand zusammen (ensemble). L'isomère Z a ses atomes d'hydrogène ensembles du même coté de la double liaison.
E est la première lettre du mot allemand entgegen (opposé). L'isomère E a ses atomes d'hydrogène disposés sur des cotés opposés de la double liaison.
Exemple: le butène
4) La photo-isomérisation
L'isomérie Z/E existe car les doubles liaisons empêchent une rotation autour de l'axe de la liaison. Un isomère Z ou E ne passe donc pas spontanément d'une forme à l'autre mais s'il est soumis à un rayonnement d'énergie adaptée alors la double liaison peut se rompre temporairement et se rétablir en formant l'autre isomère.
Ce phénomène appelé photo-isomérisation permet donc de passer d'un isomère E à un isomère Z ou d'un isomère Z à un isomère E lorsque ces derniers sont soumis à des rayonnement de longueur d'onde adaptée.
La photo-isomérisation est une réaction chimique provoquée par la lumière et fait partie des réactions photochimiques.
Autres cours de première S
Partie 1: Observer, couleurs et images
Partie 2: Comprendre, lois et modèles
Autres cours de chimie
Chimie en seconde
Chimie en première S
Chimie en terminale S
Autres cours de chimie organique
Groupes caractéristiques d'une espèce chimique
Formule développée et formule semi-développée
Formulation, principe actif et excipient d'un médicament
La formule de Lewis
Prévoir la géomètrie d'une molécule
Modification de chaine et modification de groupe caractéristique
Partie 1: Observer, couleurs et images
Partie 2: Comprendre, lois et modèles
Autres cours de chimie
Chimie en seconde
Chimie en première S
Chimie en terminale S
Autres cours de chimie organique
Groupes caractéristiques d'une espèce chimique
Formule développée et formule semi-développée
Formulation, principe actif et excipient d'un médicament
La formule de Lewis
Prévoir la géomètrie d'une molécule
Modification de chaine et modification de groupe caractéristique
©2018 Cours de physique et chimie au lycée