L'atome et son noyau
- La charge éléctrique
- Les constituants de l'atome
- Composition d'un atome
- Les isotopes
- Répartition spatiale des constituants de l'atome
La charge éléctrique
La charge électrique est une grandeur se notant "q", s'exprimant en coulomb (symbole C) et qui possède un signe (elle peut être soit positive soit négative).
La charge élémentaire est une charge éléctrique particulière noté e et de valeur:
e = 1,6 x 10-19 C
Il s'agit de la plus petite charge (en valeur absolue) que peuvent porter les nucléons, les électrons et toutes les particules qu'ils constituent en se combinant.
Toute charge "q" portée par une substance ou une particule peut s'exprimer comme un multiple de cette charge élément. Pour toute charge électrique "q" il existe donc un nombre "n" entier relatif (positif ou négatif) tel que:
Les constituants de l'atome
L'atome est constitué d'une noyau central autour duquel orbitent des électrons qui constituent le cortège électronique (aussi appelé nuage électronique).
- L'électron: c'est une particule élémentaire portant une charge électrique négative de valeur -e = -1,6 x 10-19 C.
- Le noyau: il est constitué de particules appélées nucléons. Il en existe deux sortes: les protons et les neutrons.
- Le neutron est une particule neutre: charge 0 C
- Le proton est une particule positive de charge opposée à celle de l'électron: e =1,6 x 10-19 C
Composition d'un atome
Le noyau d'un atome peut être représentée par un symbole du type:
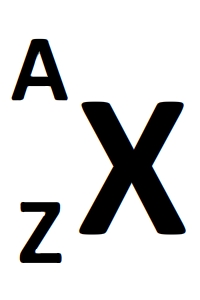
X est le symbole atomique
A est le nombre total de nucléons (aussi appelé nombre de masse)
Z est numéro atomique, il correspond au nombre de protons et il toujours plus petit que A
Ce symbole permet de déduire le nombre de neutrons (noté N):
A = N + Z
N = A – Z
Un atome étant toujours éléctriquement neutre il comporte donc autant d'électrons que de protons: Z est aussi le nombre d'électrons de l'atome.
Exemple:
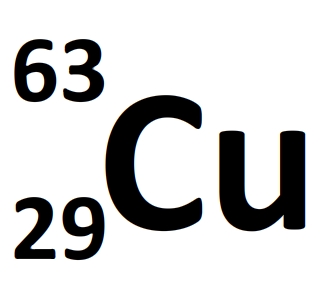
Cu: il s'agit du symbole d'un noyau d'atome de cuivre
Son numéro atomique est Z=29 donc l'atome de cuivre a 29 protons et 29 électrons
Son nombre de nucléons est A=63 donc il comporte N = 63 – 29 = 34 neutrons.
Les isotopes
Des isotopes sont des atomes constitués du même nombre de protons mais ayant un nombre de neutrons différent.
Deux atomes isotopes ont donc le même numéro atomique et des nombres de nucléons différents.
Exemple: l'atome de carbone possède toujours 6 protons dans son noyau mais il peut avoir 6, 7 ou 8 neutrons: ces trois atomes sont isotopes entre eux.
Répartition spatiale des constituants de l'atome
Le noyau d'un atome peut être assimilé à boule de rayon 10-15 m tandis que les électron se meuvent en suivant une sphère dont le rayon est de l'ordre de 10-10 m.
10-10 = 100 000
10-15
Le noyau d'un atome est environ 100 000 fois plus petit que l'atome lui-même.
Il y a beaucoup plus de vide que de matière dans un atome, pour cette raison on dit que sa structure est lacunaire.
Partie 1: L'Univers
Partie 2: La santé
Partie 3: La pratique du sport
Autres cours de chimie
Chimie en seconde
Chimie en première S
Chimie en terminale S
Autres cours sur la structure et les propriétés de la matière
L'atome et son noyau
Masse approchée d'un atome et de son noyau
Eléments chimiques
Répartition des électrons dans les couches électroniques
Ions monoatomiques
Les règles du duet et de l'octet, prévisions de la formation des ions monoatomiques
Le premier tableau périodique: le tableau de Mendeleïev
Le tableau périodique actuel
Les familles d'éléments chimiques
Masses molaires atomiques et moléculaires
Cohésion des solides ioniques
Cohésion des solides moléculaires
©2018 Cours de physique et chimie au lycée